预后是指预测可能病程和结局。肺动脉栓塞的预后评估是判断其某种情况下(特定因素)的特定后果。以下的阐述是指某种可能,主要指病人的群体而不是个人。 在病人急性肺栓塞的早期,被发现和测量的特定因素可以提示病人死亡的危险状态。 1. 影像: (1)右心室衰竭(dysfunction)-如果是正常血压和低血压病人是一起分析的,由于肺栓塞导致右心室衰竭预示增加肺栓塞相关死亡发生【1-3】。7个荟萃分析表明(3395 正常或低血压的肺栓塞病人)肺栓塞相关死亡,有右心功能衰竭的的病人增加2倍【2】。 右心衰竭预测没有低血压病人死亡的能力是不清楚的,因为并没有相关资料。上述荟萃分析资料中,仅仅分析发现右心室衰竭的正常血压病人与住院死亡相关肺栓塞【2】。相反,其它荟萃分析发现右心室衰竭是血流动力学稳定病人的2-3倍【4,5】。这一不同结果部分由于右室功能判定方法所决定的。第一篇荟萃分析评估右室功能是心动超声,而第二篇是通过超声心动或CT。 右室功能衰竭也可以预测复发性PE或DVT。一项前瞻性队列研究,首次肺栓塞301个病人被分组为没有右室功能衰竭、右室功能衰竭回归(regression)如,住院未出院、持续右室功能衰竭【6】。平均随访3年,比较没有右室功能衰竭或右室功能回归的病人,持续右室功能衰竭病人更可能发生复发性肺栓塞,复发性DVT或肺栓塞死亡。 (2)右室血栓-比没有右室血栓病人,急性肺栓塞病人和右室血栓有较高的两周死亡(12% vs 11%)和三个月死亡(29% vs 16%)【7】。 (3)深静脉血栓-表现为急性肺栓塞病人,并发现同时存在深静脉血栓会增加死亡的危险。707例急性肺栓塞病人前瞻性队列研究发现DVT的存在增加所有原因死亡率(adjusted HR 2.05, 95% CI 1.24-3.38)和增加肺栓塞特异性死亡率 (adjusted HR 4.25, 95% CI 1.61-11.25)【8】。 2. 实验室: (1)脑钠肽(Brain natriuretic peptides ,BNP)-- 脑钠肽或N-末端脑利钠肽前体( N-terminal pro-brain natriuretic peptide ,NT升高预测右室功能衰竭和死亡,虽然理想的危险分层截止值并不清楚【9-12】。16项荟萃分析发现如果BNP>100pg/ml,短期死亡增加6倍,如果N-末端脑利钠肽前体>600ng/L 增加16倍【9】。 BNP和NT-proBNP可能预示其它不良后果。在一项连续73例诊断急性肺栓塞病人的观察研究中,血清BNP>90pg/ml(报告4小时内下降)和心肺复苏、机械通气、血管加压、溶栓和内膜切除相联系,也和死亡相关【13】。血清BNP<50pg/ml ,发现95%病人临床过程良好。 (2)血清肌钙蛋白(Serum troponins )-血清肌钙蛋白升高增加肺栓塞病人死亡【13-16】。20个观察研究(1985例病人)荟萃分析,发现病人肌钙蛋白I 或肌钙蛋白T水平升高,增加短期死亡(OR 5.24, 95% CI 3.28-8.38)或肺栓塞 (OR 9.44, 95% CI 4.14-21.49)死亡危险【13】。 血清肌钙蛋白水平可以联合NT-proBNP水平得到更精确的预后信息。100例连续肺栓塞病人前瞻性研究,肌钙蛋白T水平>0.07mcg/L + NT-proBNT≥600ng/L 40天死亡比肌钙蛋白 T >0.07mcg/L+NT-proBNP水平<600ng/L(33% vs 0%)【17】。 (3)低钠血症(Hyponatremia)-患者存在低钠血症的时候与增加死亡和再入院相关。这被主要诊断为肺栓塞,两年13728例回顾性队列研究【18】所证实。这些病人中,比较钠水平>135mmol/L,钠水平130-135mmol/L (odds ratio 1.53, 95% CI 1.33-1.76) 或钠水平<130mmol/L(odds ratio 3.26, 95% CI 2.48-4.29),30天死亡率增加。这些病人中绝对30天死亡率如下表。30天再入院率表现为低钠血症的病人也更常见。
(4)乳酸(lactate)-乳酸水平的升高对急性肺栓塞病人预测有预测价值【19】。一项单中心研究,在急诊室诊断急性肺栓塞270例病人,当比较低乳酸水平与高乳酸水平病人(>2mmoles/L),后者有较高的死亡率(17.3% vs 1.6%)。血浆乳酸水平与所有原因死亡相关,并独立于休克或低血压、右室功能衰竭肌钙蛋白值。需要进一步研究证实乳酸水平作为急性肺栓塞精确的预后因子。 3. 预后模型(prognostic model)- 预后或预测模型可以方便治疗决定,或门诊或住院。有几种预后模型已经获得并在急性肺栓塞患者得到验证,它们中肺栓塞严重指数(Pulmonary Embolism Severity Index,PESI)和它的简化版( sPESI)是最常见的(下表)【20-23】 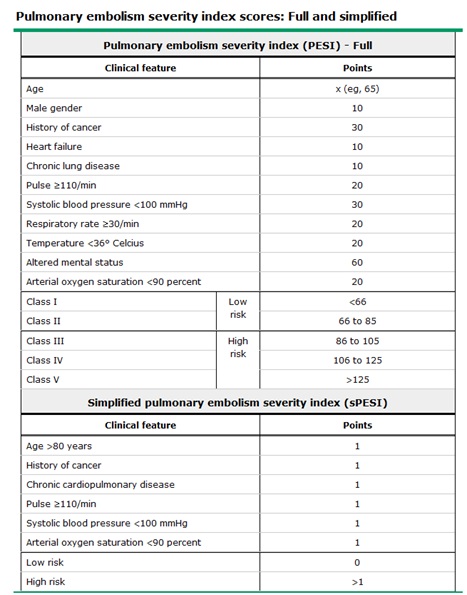 多数模型应用发病时(at presentation)所收集的临床资料,按照死亡或并发症(如复发性肺栓塞)分层病人。当PESI或sPESI较大程度上预测死亡,较新的综合成的模型预测死亡或/和并发症。预后模型的例子包括如下: 1. PESI -原有的EPSI通过添加病人的年龄分配到10个变量的每一点获得总分【20】:男性(+10点),癌症历史(+30点),心衰(+10点),慢性肺疾病(+10点),心搏≥110bpm(+20点),收缩压<100mmHg(+30点),呼吸频率≥30次/分(+20点),体温<36°C(+20),精神状态改变(+60),需氧饱和度<90%(+20)。按照增加死亡率分类病人,I级危险(<66点),II级危险(66-85点),III级危险(86-105点),IV级危险(106-125),V级危险(>125点)。PESI的主要限制是很难用于繁忙紧张的临床情况,因为很多变异需要考虑,每个都有自己的权重。 2. sPESI- 分配给下列变量一个点, 年龄>80岁,癌症病史,慢性肺心病,心率>110次/分,收缩压<100mmHg,需氧饱和度<90%。总分为零分为低风险死亡,而总分>为高风险[【24】。 sPESI似乎有预后的精确性类似原先的PESI。996例队列研究显示,由sPESI分类为低风险的病人,30天死亡率为1%,而分类为高风险病人30天死亡率为10.9%【24】。相比较,病人为原先PESI分类为低风险病人30天死亡率为2.5%,而分类为高风险病人30天死亡率为10.9%。但还需要前瞻性研究证实sPESI。 3. 其它- 一种多标志(multimarker)模型,其联合sPESI,脑钠肽,心肌钙蛋白I 和下肢超声(入院48小时完成)被获得和证实于848例正常血压的急性肺栓塞患者的队列研究【23】。低危险sPESI结合BNP<100pg/mL显示病人30天死亡风险、血流动力学崩溃和复发性肺栓塞危险较低(阴性预测值99-100%)。所有4个模型组合结合一起,发现在30天死亡或并发症病人(阳性预测值,21%-26%)。在临床应用之前,这一模型还需要进一步的证实 1. Goldhaber SZ, Visani L, De Rosa M. Acute pulmonary embolism: clinical outcomes in the International Cooperative Pulmonary Embolism Registry (ICOPER). Lancet 1999; 353:1386. 2. ten Wolde M, Söhne M, Quak E, et al. Prognostic value of echocardiographically assessed right ventricular dysfunction in patients with pulmonary embolism. Arch Intern Med 2004; 164:1685. 3. Becattini C, Casazza F, Forgione C, et al. Acute pulmonary embolism: external validation of an integrated risk stratification model. Chest 2013; 144:1539. 4. Sanchez O, Trinquart L, Colombet I, et al. Prognostic value of right ventricular dysfunction in patients with haemodynamically stable pulmonary embolism: a systematic review. Eur Heart J 2008; 29:1569. 5. Trujillo-Santos J, den Exter PL, Gómez V, et al. Computed tomography-assessed right ventricular dysfunction and risk stratification of patients with acute non-massive pulmonary embolism: systematic review and meta-analysis. J Thromb Haemost 2013; 11:1823. 6. Grifoni S, Vanni S, Magazzini S, et al. Association of persistent right ventricular dysfunction at hospital discharge after acute pulmonary embolism with recurrent thromboembolic events. Arch Intern Med 2006; 166:2151. 7. Torbicki A, Galié N, Covezzoli A, et al. Right heart thrombi in pulmonary embolism: results from the International Cooperative Pulmonary Embolism Registry. J Am Coll Cardiol 2003; 41:2245. 8. Jiménez D, Aujesky D, Díaz G, et al. Prognostic significance of deep vein thrombosis in patients presenting with acute symptomatic pulmonary embolism. Am J Respir Crit Care Med 2010; 181:983. 9. Cavallazzi R, Nair A, Vasu T, Marik PE. Natriuretic peptides in acute pulmonary embolism: a systematic review. Intensive Care Med 2008; 34:2147.
10. Klok FA, Mos IC, Huisman MV. Brain-type natriuretic peptide levels in the prediction of adverse outcome in patients with pulmonary embolism: a systematic review and meta-analysis. Am J Respir Crit Care Med 2008; 178:425.
11. Lega JC, Lacasse Y, Lakhal L, Provencher S. Natriuretic peptides and troponins in pulmonary embolism: a meta-analysis. Thorax 2009; 64:869. 12. Lankeit M, Jiménez D, Kostrubiec M, et al. Validation of N-terminal pro-brain natriuretic peptide cut-off values for risk stratification of pulmonary embolism. Eur Respir J 2014; 43:1669. 13. Becattini C, Vedovati MC, Agnelli G. Prognostic value of troponins in acute pulmonary embolism: a meta-analysis. Circulation 2007; 116:427. 14. Becattini C, Casazza F, Forgione C, et al. Acute pulmonary embolism: external validation of an integrated risk stratification model. Chest 2013; 144:1539. 15. Jiménez D, Uresandi F, Otero R, et al. Troponin-based risk stratification of patients with acute nonmassive pulmonary embolism: systematic review and metaanalysis. Chest 2009; 136:974. 16. Janata KM, Leitner JM, Holzer-Richling N, et al. Troponin T predicts in-hospital and 1-year mortality in patients with pulmonary embolism. Eur Respir J 2009; 34:1357. 17. Kostrubiec M, Pruszczyk P, Bochowicz A, et al. Biomarker-based risk assessment model in acute pulmonary embolism. Eur Heart J 2005; 26:2166. 18. Scherz N, Labarère J, Méan M, et al. Prognostic importance of hyponatremia in patients with acute pulmonary embolism. Am J Respir Crit Care Med 2010; 182:1178. 19. Vanni S, Viviani G, Baioni M, et al. Prognostic value of plasma lactate levels among patients with acute pulmonary embolism: the thrombo-embolism lactate outcome study. Ann Emerg Med 2013; 61:330. 20. Aujesky D, Obrosky DS, Stone RA, et al. Derivation and validation of a prognostic model for pulmonary embolism. Am J Respir Crit Care Med 2005; 172:1041. 21. Wicki J, Perrier A, Perneger TV, et al. Predicting adverse outcome in patients with acute pulmonary embolism: a risk score. Thromb Haemost 2000; 84:548. 22. Uresandi F, Otero R, Cayuela A, et al. [A clinical prediction rule for identifying short-term risk of adverse events in patients with pulmonary thromboembolism]. Arch Bronconeumol 2007; 43:617. 23. Jiménez D, Kopecna D, Tapson V, et al. Derivation and validation of multimarker prognostication for normotensive patients with acute symptomatic pulmonary embolism. Am J Respir Crit Care Med 2014; 189:718. 24. Jiménez D, Aujesky D, Moores L, et al. Simplification of the pulmonary embolism severity index for prognostication in patients with acute symptomatic pulmonary embolism. Arch Intern Med 2010; 170:1383. |

|